歐盟MDR / IVDR
歐盟醫療器材法規(EU)2017/745 Medical Device Regulation(MDR)與 體外診斷醫療器材法規(EU)2017/746 In Vitro Diagnosis Device Regalation(IVDR),歐盟醫療器材新法的建立,其目標為強化醫材資訊的透明度及可追溯性,保障歐盟市場上流通的所有醫療器材符合最高的安全和性能要求,以保障民眾的健康福祉。歐盟委員會對於MDR與IVDR的要求在醫材範圍定義上更廣,更新醫材分級分類,以及對臨床證據的要求更為嚴格;為了提升醫療器材之生命週期監督管理的透明度,歐盟委員會建置了歐盟醫療器材資料庫 EUDAMED (European database on medical devices ),公開資訊供查閱。
歐盟MDR申請(輔導)重點
1. MDR新角色及經濟運作體
2. 判定器材之風險等級異動
3. 選擇符合性評鑑程序
4. 適用之安全性及性能需求(GSPR)
5. 提升技術文件及品質系統之嚴謹度
6. 醫療器材單一識別系統(UDI)
7. 宣告符合性聲明(DoC)
8. CE 標誌及上市後監督(PMS/PSUR)
9. 建置EUDAMED 醫材資料庫
10. 對臨床評估證據的要求更嚴格
2. 判定器材之風險等級異動
3. 選擇符合性評鑑程序
4. 適用之安全性及性能需求(GSPR)
5. 提升技術文件及品質系統之嚴謹度
6. 醫療器材單一識別系統(UDI)
7. 宣告符合性聲明(DoC)
8. CE 標誌及上市後監督(PMS/PSUR)
9. 建置EUDAMED 醫材資料庫
10. 對臨床評估證據的要求更嚴格
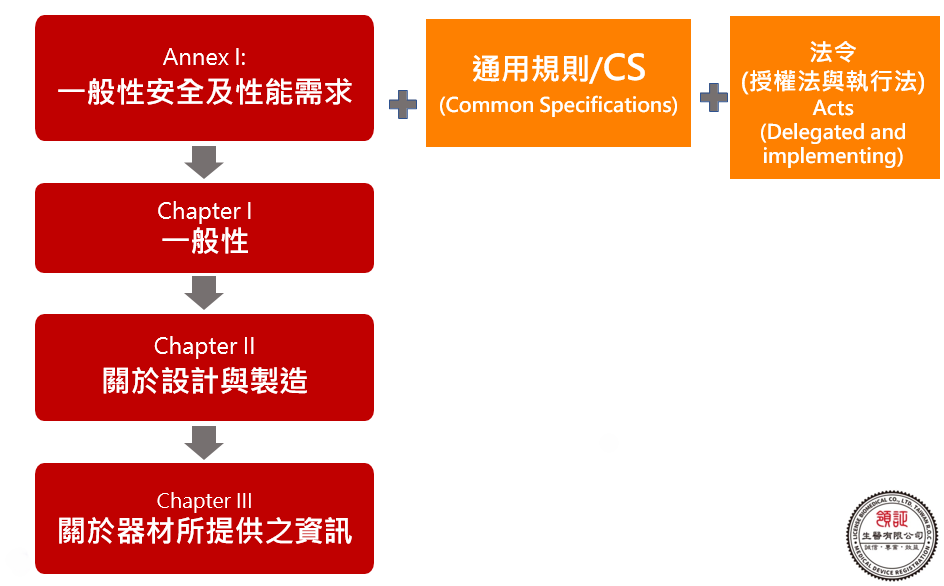
歐盟MDR輔導之一般安全及性能要求(23項GSPR)
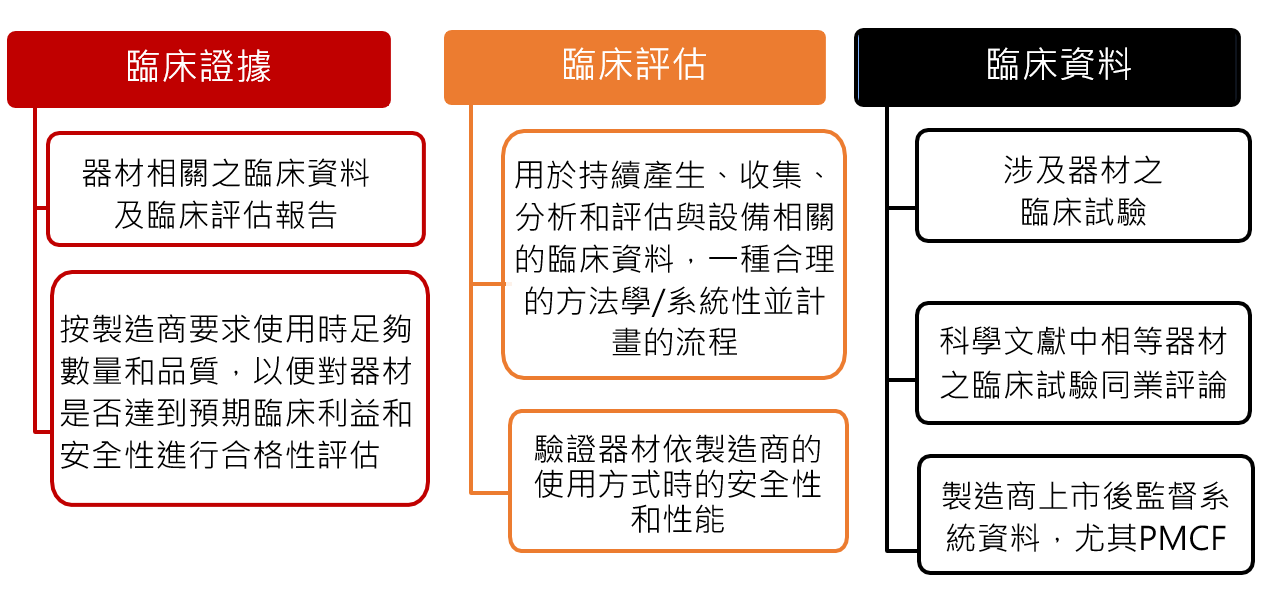
歐盟MDR輔導之臨床評估報告(關鍵重要)
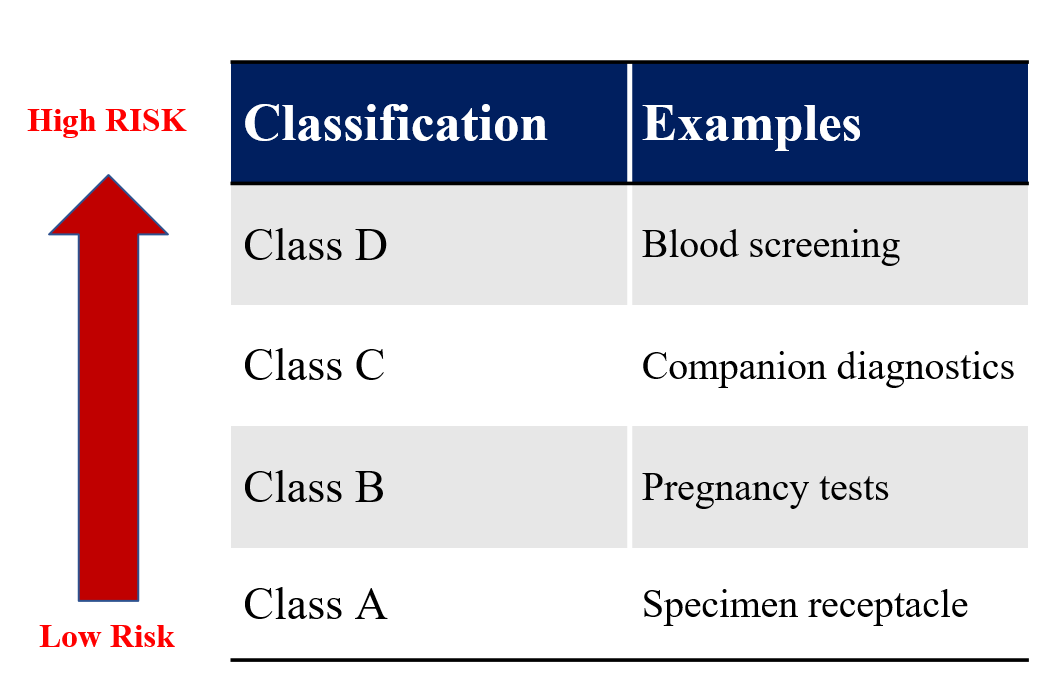
歐盟 IVDR 申請輔導分類重點
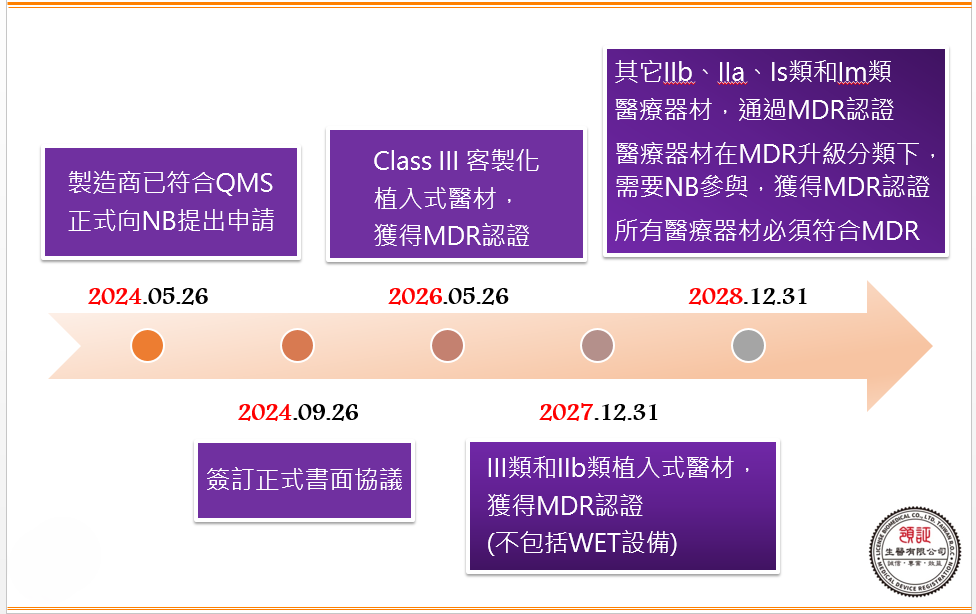
歐盟MDR申請最新之過渡期
MDR申請輔導之EUDAMED:
歐盟醫療器材資料庫 EUDAMED (European database on medical devices ) 為歐盟建置的醫療器材單一識別系統資料庫作為實施 MDR 和IVDR 的IT系統。該資料庫旨在提高醫療器材透明度,公開醫材資訊提供公眾和醫療從業人員查閱,同時強化歐盟成員國之間的協調。該系統即時展示在歐盟上市的醫療器材的生命週期,整合了六個模組,用於管理醫療器材經濟運作體和監管單位間的資訊 :
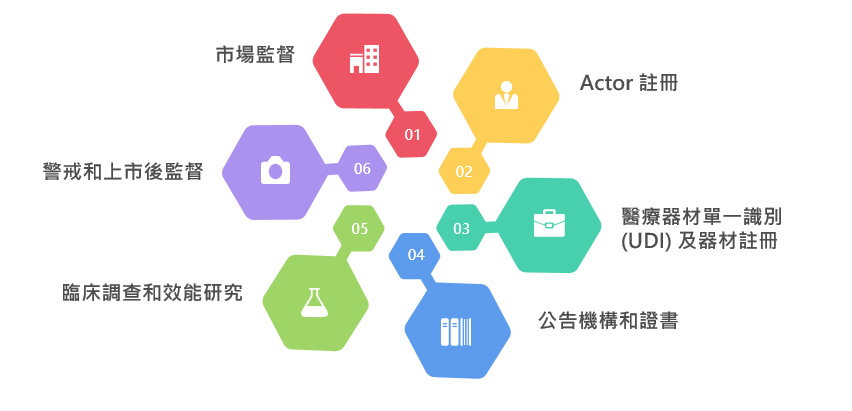
歐盟醫療器材資料庫 EUDAMED 連結:https://reurl.cc/WRZkqk

歐盟醫療器材資料庫 EUDAMED 連結:https://reurl.cc/WRZkqk
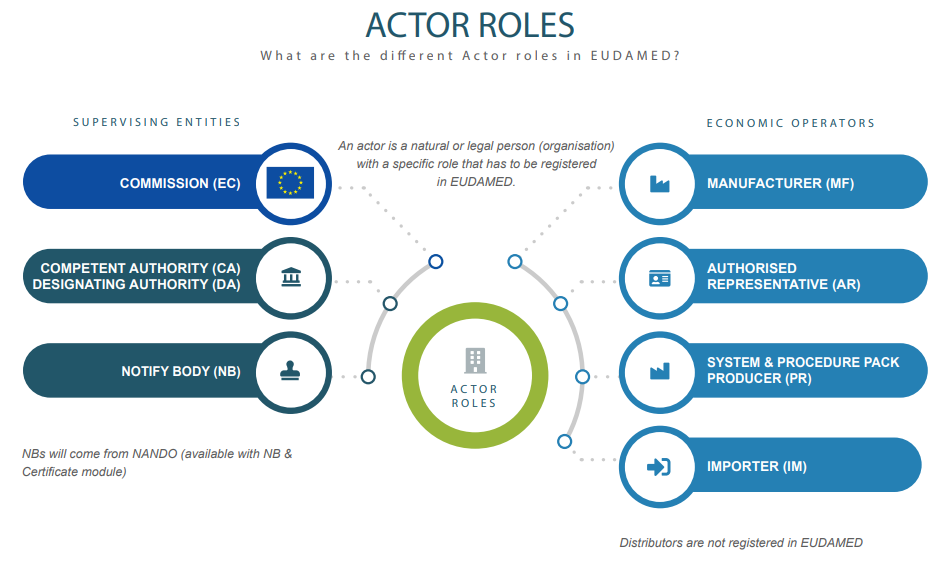
哪些機構(Who)應該要註冊Actor並取得SRN (Single Registration Number):
製造商、授權代表(或稱歐體代表)、進口商、系統/程式製作者(系統商)。
須於何時完成登錄:
1. 自我宣告醫材在授權代表(AR)完成技術文件(Technical Document,TD)確認後、醫材出口到歐洲前須完成登錄。
2. 公告機構(NB)參與審查的醫材應該審查完成取得證書,並且將技術文件(Technical Document, TD)交給授權代表(AR)確認後,醫材出口到歐盟前完成登錄。
MDR申請輔導之 Actor registration module:
1.Actor 註冊是六個 EUDAMED 模組中的第一個。
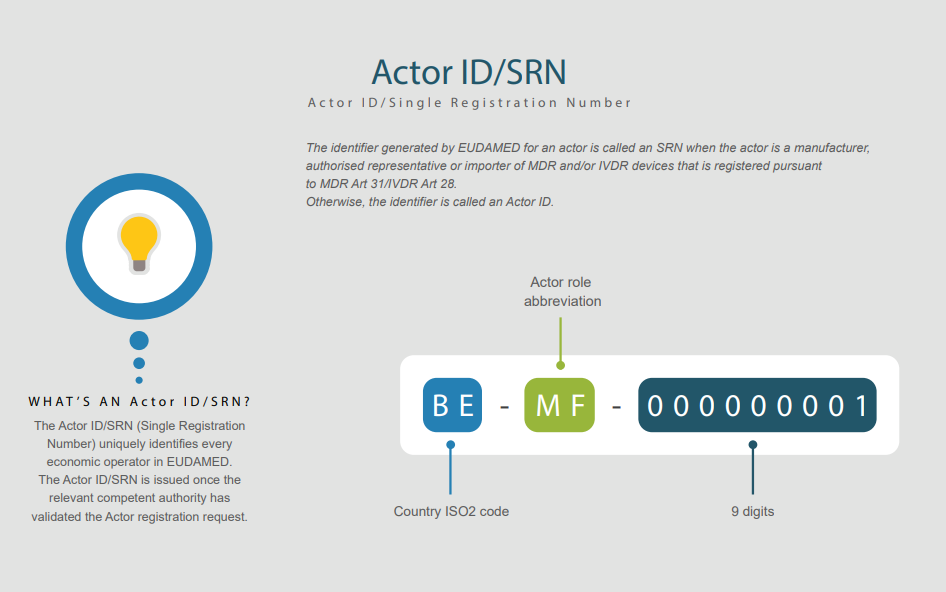
2.Actor 識別碼/單一註冊號碼(SRN)Actor註冊模組使經濟運營商能夠透過Actor註冊請求提交獲得Actor識別碼/單一註冊號碼(Actor ID/SRN)所需的資訊。
3. Actor ID/SRN 保證了經濟運營商(也在 EUDAMED 之外)在歐盟範圍內的唯一識別。


MDR申請輔導之Basic UDI-DI :
1. Basic UDI-DI 定義:
歐盟 MDR(2017 / 745)與 IVDR(2017 / 746)Annex VI Part C 定義 Basic UDI-DI 是不同於 UDI-DI,它是產品型號的主要識別,不是針對單一產品,而是針對一組類型的產品,是 EUDAMED 資料庫記錄的主要關鍵,並引用於歐盟證書(Certificate)、符合性聲明(Declaration of Conformity)、技術文件(Technical Documentation)及安全性和臨床效能摘要(Summary of Safety and Clinical Performance)。 2. Basic UDI-DI 於 GMN 編碼方式為企業自行編訂 :

3. Basic UDI-DI 與 UDI-DI 關係及其不同之處:
Basic UDI-DI(GMN)與 UDI-DI(GTIN)兩者的用途不相同,Basic UDI-DI(GMN)只要求編號無需印製條碼,不像UDI-DI(GTIN)會有實體條碼或資料載體(Data Carrier),而一個 Basic UDI-DI(GMN)可以對應超過一個以上的 UDI-DI(GTIN),但 Basic UDI-DI(GMN)不能作為供應鏈識別或交易目的(例如:標籤、訂單、交貨、付款),供應鏈識別只能使用UDI-DI(GTIN),所以 UDI-DI(GTIN)不能用於取代 Basic UDI-DI(GMN),反之亦然。
2.Actor 識別碼/單一註冊號碼(SRN)Actor註冊模組使經濟運營商能夠透過Actor註冊請求提交獲得Actor識別碼/單一註冊號碼(Actor ID/SRN)所需的資訊。
3. Actor ID/SRN 保證了經濟運營商(也在 EUDAMED 之外)在歐盟範圍內的唯一識別。




MDR申請輔導之Basic UDI-DI :
1. Basic UDI-DI 定義:
歐盟 MDR(2017 / 745)與 IVDR(2017 / 746)Annex VI Part C 定義 Basic UDI-DI 是不同於 UDI-DI,它是產品型號的主要識別,不是針對單一產品,而是針對一組類型的產品,是 EUDAMED 資料庫記錄的主要關鍵,並引用於歐盟證書(Certificate)、符合性聲明(Declaration of Conformity)、技術文件(Technical Documentation)及安全性和臨床效能摘要(Summary of Safety and Clinical Performance)。 2. Basic UDI-DI 於 GMN 編碼方式為企業自行編訂 :

3. Basic UDI-DI 與 UDI-DI 關係及其不同之處:
Basic UDI-DI(GMN)與 UDI-DI(GTIN)兩者的用途不相同,Basic UDI-DI(GMN)只要求編號無需印製條碼,不像UDI-DI(GTIN)會有實體條碼或資料載體(Data Carrier),而一個 Basic UDI-DI(GMN)可以對應超過一個以上的 UDI-DI(GTIN),但 Basic UDI-DI(GMN)不能作為供應鏈識別或交易目的(例如:標籤、訂單、交貨、付款),供應鏈識別只能使用UDI-DI(GTIN),所以 UDI-DI(GTIN)不能用於取代 Basic UDI-DI(GMN),反之亦然。
Source: GS1


