TFDA 醫材註冊輔導
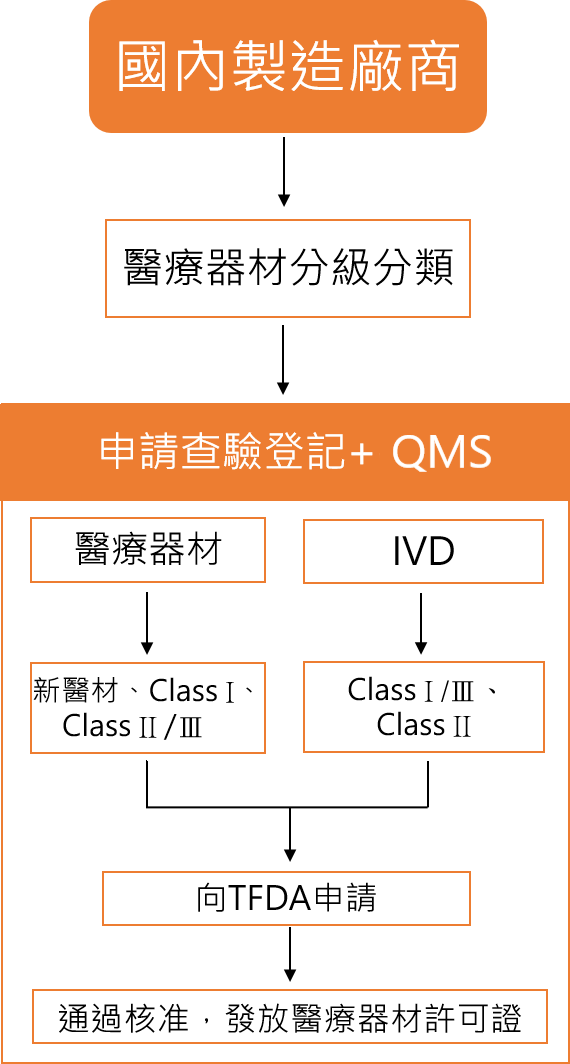
TFDA依<醫療器材管理法>嚴格控管醫療器材產品之全生命週期,從醫療器材商、醫材製造、醫材上市前把關、醫材上市後監督、以及通路控管;醫療器材商們在醫材產品上市販售前必須依其分級分類及<醫療器材許可證核發與登錄及年度申報準則>之規定,向TFDA申請醫材許可證查驗登記。
領証醫材法規顧問具備多國醫療器材註冊申請實務經驗豐沛,更具備了17年以上衛生主管機關 (TFDA及CDE)之醫療器材註冊及臨床試驗審查經驗,此外更受聘於多家醫學中心等級醫院之人體試驗委員會IRB諮詢委員專家。
領証顧問可提供您需要的醫材法規諮詢輔導,專業且高附加價值的回饋,不論您的產品是現有的醫材類別還是創新、高風險醫材,領証顧問從判斷醫材適用的申請模式,到最新法規的研究、技術文件整備送審至主管機關答辯,顧問團隊全程輔導貴司充分了解關於醫療器材的法規與規範,讓您的醫材產品在最具效益的時間內快速取得醫材許可證成功上市
TFDA醫材QMS及許可證申請流程
TFDA 醫材分類分級
醫療器材判定依功能、用途、使用方法及工作原理,視應用之科別分為16大類,而其風險程度則分三個等級:CLASS I 第一等級 (低風險性)、CLASS II 第二等級 (中風險性),及CLASS III 第三等級 (高風險性)。<醫療器材分類分級管理辦法>。
若醫材製造業者無法判斷生產的產品是否屬於醫療器材,可向TFDA提出<醫療器材屬性管理查詢申請> 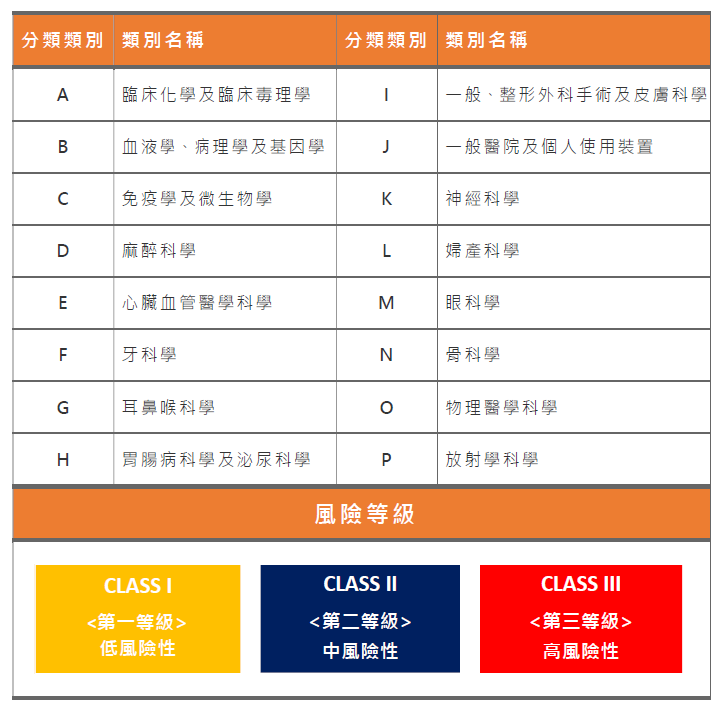
TFDA許可證代辦申請顧問輔導
食藥署TFDA醫療器材查驗登記(註冊)代辦
TFDA許可證代辦申請輔導流程
Check1. 判斷是否屬列管之醫療器材?
若產品非屬醫療器材範疇,無須辦理醫療器材查驗登記。
可先查詢我國醫療器材分類分級之「鑑別」(醫療器材分類分級管理辦法附表),產品若符合任一分類項目即屬醫療器材列管。
若為輸入產品,可參考輸入國家之規定,如詢問原製造廠該國是否將此產品列入醫療器材管理,但為參考用,仍應以我國規定為主。
如仍不能確定時,可向本署提出「醫療器材屬性管理查詢」申請,判定產品是否以醫療器材列管。
Check2. 判斷醫療器材分類分級?與有無類似品?
依衛生福利部公佈之醫療器材分類分級管理辦法附表中之醫療器材分類分級品項之規定。
查詢類似品的方式:
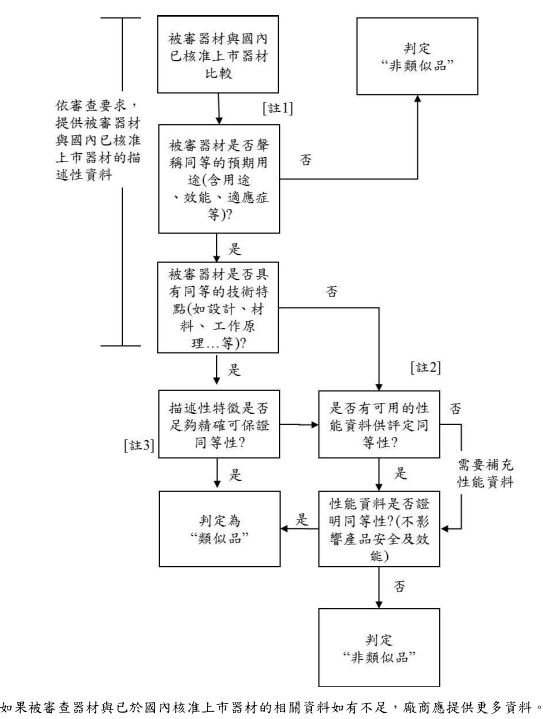
送審前請至「西藥、醫療器材及化粧品許可證查詢系統」查詢,確認是否有已核准之類似品。(類似品定義參考醫療器材許可證核發與登錄及年度申報準則第二條,類似品指具有下列條件之一,於國內已取得許可證或登錄之醫療器材:(一) 與擬申請許可證或登錄之醫療器材,具有同等預期用途及技術特點。(二)與擬申請許可證或登錄之前款以外醫療器材,具有同等預期用途,不同技術特點,而不影響產品安全及效能。)
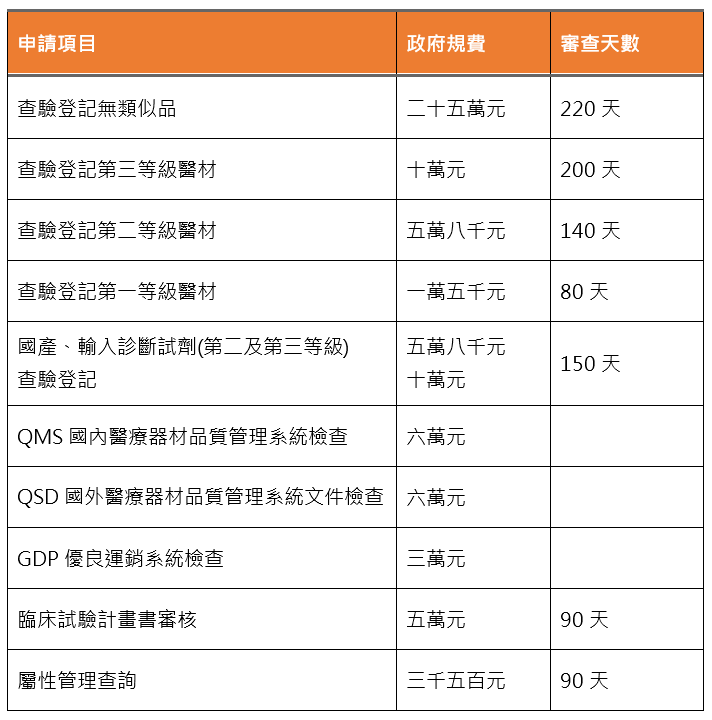
第2、3等級醫療器材申請查驗登記時,請提供1-2個最相似的類似品資料,包括其標籤說明書核定本、使用說明書;或製作產品比較表。
Check3. 不同等級之送件方式
●第一等級(Class I)(含一般醫材及IVD醫材):
第一等級醫療器材查驗登記之申辦相關事項,請參閱以下網頁:
http://www.fda.gov.tw/TC/siteContent.aspx?sid=11647
●第二、三等級(Class II/III)(含一般醫材及IVD醫材):
郵寄或親送至收件櫃台。
所需文件:
1.醫療器材查驗登記申請書、
2.標籤、說明書或包裝擬稿二份、
3.醫療器材商許可執照影本,
4.相關行政檔、技術檔及測試報告。
詳細內容請參考醫療器材許可證核發與登錄及年度申報準則。
準備文件請參考查驗登記準備文件說明及參考資料。
IVD產品另需參閱「體外診斷醫療器材查驗登記須知」。
送審資料宜編列目錄及頁碼,以方便核對。
送審資料請勿裝訂成冊,以利審查及後續歸檔作業。
Source: TFDA
TFDA許可證代辦申請輔導
1. 類似品判定流程
2. 查無類似品者,須檢附臨床試驗(Clinical trial)/臨床評估 (Clinical study、Clinical evaluation)報告及審查費(費用詳見醫療器材行政規費收費標準)。
3. 請務必先行確認是否有類似品,如逕以一般醫材方式辦理,待審查確認時,可能會影響案件之審查時效。
4. 醫療器材安全性與功效性基本規範及技術文件摘要
(1)申請第三等級醫療器材查驗登記應檢具之。
(2)申請第二等級醫療器材有醫療器材許可證核發與登錄及年度申報準則附表二說明七(二)之1項情形者,應檢附本項文件。
(3)https://www.fda.gov.tw/tc/siteContent.aspx?sid=11665
Source : TFDA
TFDA申請醫材技術文件輔導與撰寫
-
風險管理報告(ISO 14971)
-
可用性(人因工程)評估報告(IEC 62366-1)
-
軟體確效報告(IEC 62304)
-
網路安全報告
-
AI/ML人工智慧軟體報告
-
臨床試驗(評估)報告(CRO)