歐盟委員會通過,歐盟MDR過渡期延長至2028年
歐盟於2023年1月6日發佈,決定延遲實施新《醫療器材法規》(Medical Device Regulation, MDR),以延長醫材新法認證的最後期限。
歐盟執行委員會表示,截止日期取決醫材風險等級,其展緩新制的實施是為了確保患者可繼續獲得所需醫材,其各風險等級醫材過渡延長期效如下圖:
- CLASS III 植入式客製醫材 : 過渡期延長至 2026年5月26日
- CLASS III / CLASS IIb 高風險醫材 : 過渡期延長至 2027年12月31日
- CLASS IIa/ CLASS I 中低風險醫材 : 過渡期延長至 2028年12月31日
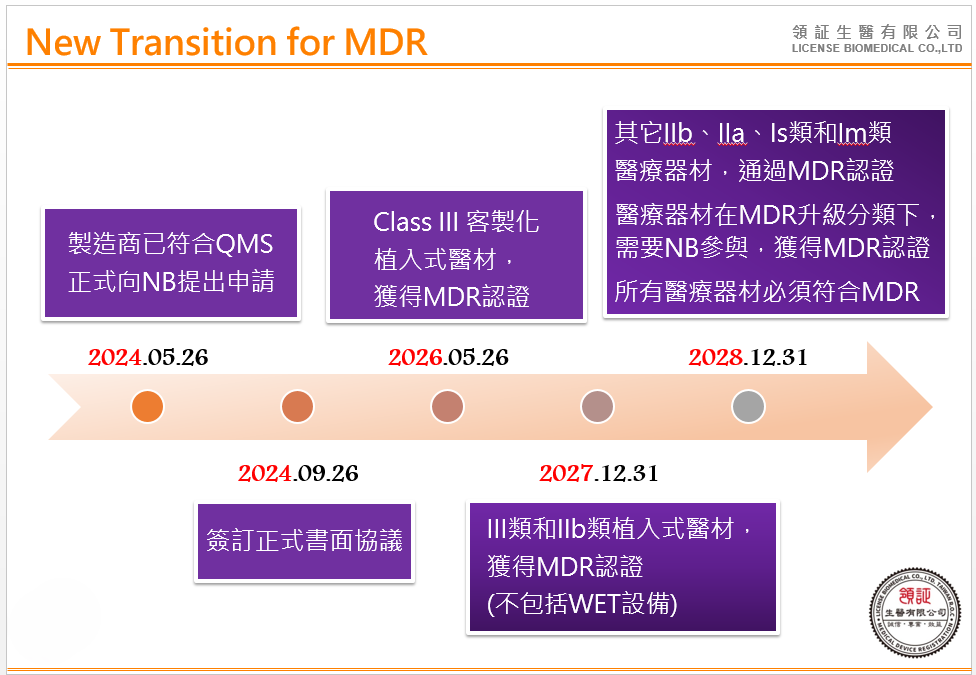
※該提案要求製造商應於2024年5月26日前向NB提出MDR申請,並在2024年9月26日前與NB完成MDR申請合約簽署。
※修改過渡性條款並無改變《醫療器材法規》MDR中的條文規範,確保醫材製造廠有更充足時間逐步完成MDD指令過渡到MDR法規。
MDR資訊來源: https://ec.europa.eu/commission/presscorner/detail/en/ip_23_23
MDR圖片來源: https://www.bsigroup.com/zh-TW/


